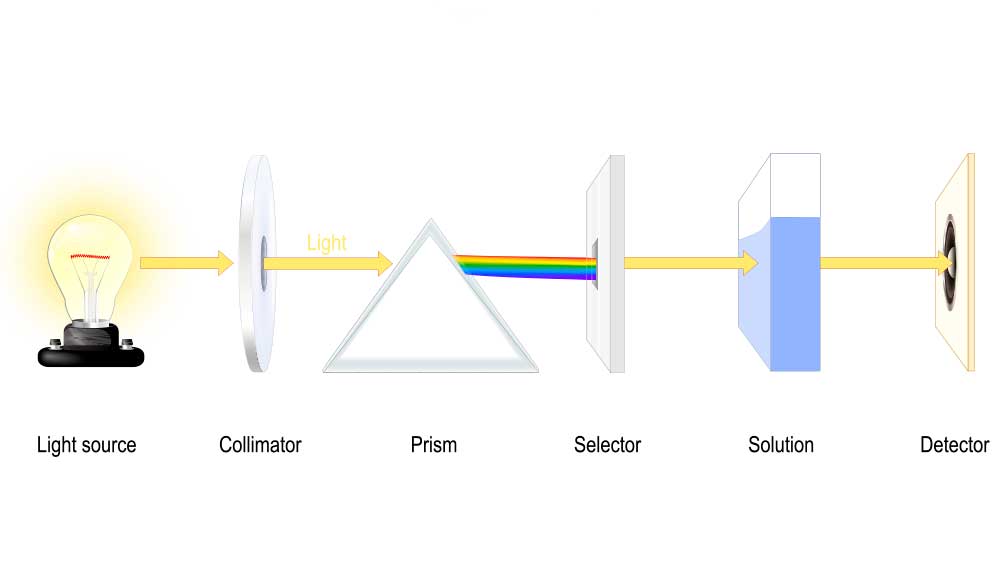
La espectroscopia usa el principio propuesto por Isaac Newton en el siglo XVIII, según el cual la luz blanca es una combinación de diferentes luces de colores que puede ser descompuesta haciendo pasar un haz de luz por un prisma (obtenemos una especie de arcoiris que se conoce como espectro continuo).
En 1814 Joseph von Fraunhofer utilizó este hecho e hizo pasar la luz solar por un prisma, magnificando a continuación el espectro resultante. Su sorpresa fue mayúscula cuando descubrió alrededor de 600 líneas finas y oscuras en el mismo. Una especie de vacíos en el espectro solar continuo. Había observado las primeras líneas espectrales solares.
Unos 50 años más tarde, Robert Bunsen y Gustav Kirchhoff, utilizando un mechero Bunsen de gas, añadiendo a la llama diferentes sustancias y haciendo pasar la luz emitida a través de un prisma, se dieron cuenta de que cada elemento químico producía su propio espectro característico, único y diferente al de todos los demás. Una especie de código de barras de colores identificativo. “Su huella digital”.
Hoy sabemos que cuando una sustancia está muy caliente emite luz en todas las longitudes de onda en un espectro continuo. Si esa radiación continúa pasa a través de una nube de gas, los átomos constituyentes del gas absorben ciertas longitudes de onda de acuerdo con su composición química.
El resto de la luz atraviesa la nube de manera que los astrofísicos detectamos un espectro de absorción, en el que ciertas longitudes de onda han sido absorbidas por el gas.
Por otro lado, cuando los astrofísicos detectamos un espectro de una nube de gas que no tiene una fuente de luz detrás, observamos las líneas de emisión del propio gas. Estas líneas constituyen el espectro de líneas de emisión del gas. Para cada gas, las longitudes de onda de las líneas de emisión y absorción son las mismas.
El espectro de emisión/absorción de cualquier gas está íntimamente relacionado con la estructura atómica de sus átomos. En concreto el modelo de Bohr del átomo nos permite realizar una primera aproximación a este hecho, y relacionar la absorción de luz por un átomo con las transiciones electrónicas que se producen por la excitación de los electrones constituyentes, es decir con los saltos energéticos de los electrones desde el nivel fundamental a los otros niveles energéticos permitidos. Y de manera equivalente el espectro de emisión corresponde a las transiciones electrónicas desde los niveles excitados al fundamental.
Puedes practicar con el modelo de Bohr, las transiciones electrónicas y el espectro atómico con esta simulación:
Espectrógrafo
Este instrumento se coloca en los telescopios para detectar las líneas espectrales de los objetos astronómicos. Un espectrógrafo incluye un prisma o una red de difracción que se utiliza para dispersar la luz del objeto y un detector, normalmente una CCD, para recoger el espectro (medir la intensidad).
Tras la reducción de los datos y el análisis obtenemos curvas como las siguientes:
Aplicaciones de la espectroscopia
Los astrofísicos pueden comparar las líneas espectrales que observan en los espectros de los objetos astronómicos con las líneas espectrales de elementos conocidos y de esta forma deducir la composición química y la temperatura de dichos objetos.
También pueden estudiar su movimiento a partir del desplazamiento al rojo o al azul de las líneas espectrales (Efecto Doppler) , lo cual se utiliza, por ejemplo, para estudiar el movimiento de las galaxias, para encontrar sistemas estelares binarios e incluso para encontrar exoplanetas orbitando alrededor de otras estrellas.